- Pengarang Alex Aldridge [email protected].
- Public 2023-12-17 13:42.
- Terakhir diubah 2025-06-01 07:36.
Perbedaan Kunci - Ligan Kuat vs Ligan Lemah
Ligan adalah atom, ion, atau molekul yang menyumbangkan atau membagi dua elektronnya melalui ikatan kovalen koordinat dengan atom atau ion pusat. Konsep ligan dibahas dalam kimia koordinasi. Ligan adalah spesies kimia yang terlibat dalam pembentukan kompleks dengan ion logam. Oleh karena itu, mereka juga dikenal sebagai agen pengompleks. Ligan dapat berupa Monodentat, bidentat, tridentat, dll. berdasarkan densitas ligan. Densitas adalah jumlah gugus donor yang ada dalam suatu ligan. Monodentat berarti ligan hanya memiliki satu gugus donor. Bidentat berarti memiliki dua kelompok donor per satu molekul ligan. Ada dua jenis ligan utama yang dikategorikan berdasarkan teori medan kristal; ligan kuat (atau ligan medan kuat) dan ligan lemah (atau ligan medan lemah). Perbedaan utama antara ligan kuat dan ligan lemah adalah bahwa pemisahan orbital setelah mengikat ligan medan kuat menyebabkan perbedaan yang lebih tinggi antara orbital tingkat energi yang lebih tinggi dan lebih rendah sedangkan pemisahan orbital setelah mengikat ligan medan lemah menyebabkan perbedaan yang lebih rendah antara orbital tingkat energi yang lebih tinggi dan lebih rendah.
Apa itu Teori Medan Kristal?
Teori medan kristal dapat digambarkan sebagai model yang dirancang untuk menjelaskan pemecahan degenerasi (kulit elektron dengan energi yang sama) dari orbital elektron (biasanya orbital d atau f) karena medan listrik statis yang dihasilkan oleh lingkungan sekitar. anion atau anion (atau ligan). Teori ini sering digunakan untuk menunjukkan perilaku kompleks ion logam transisi. Teori ini dapat menjelaskan sifat magnetik, warna kompleks koordinasi, entalpi hidrasi, dll.
Teori:
Interaksi antara ion logam dan ligan terjadi akibat gaya tarik menarik antara ion logam yang bermuatan positif dan muatan negatif dari elektron ligan yang tidak berpasangan. Teori ini terutama didasarkan pada perubahan yang terjadi pada lima orbital elektron yang terdegenerasi (sebuah atom logam memiliki lima orbital d). Ketika ligan mendekati ion logam, elektron yang tidak berpasangan lebih dekat ke beberapa orbital d daripada orbital d lainnya dari ion logam. Hal ini menyebabkan hilangnya degenerasi. Dan juga, elektron pada orbital d menolak elektron ligan (karena keduanya bermuatan negatif). Oleh karena itu, orbital d yang lebih dekat ke ligan memiliki energi yang lebih tinggi daripada orbital d lainnya. Hal ini mengakibatkan pemisahan orbital d menjadi orbital d berenergi tinggi dan orbital d berenergi rendah, berdasarkan energi.
Beberapa faktor yang mempengaruhi pemisahan ini adalah; sifat ion logam, keadaan oksidasi ion logam, susunan ligan di sekitar ion logam pusat dan sifat ligan. Setelah pemisahan orbital d ini berdasarkan energi, perbedaan antara orbital d energi tinggi dan rendah dikenal sebagai parameter pemisahan medan kristal (∆okt untuk kompleks oktahedral).
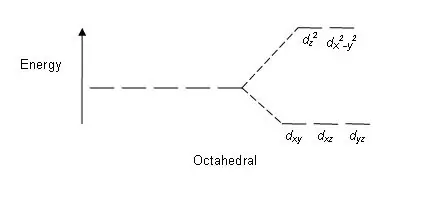
Gambar 01: Pola Pemisahan dalam Kompleks Oktahedral
Pola pemisahan: Karena ada lima orbital d, pemisahan terjadi dengan perbandingan 2:3. Dalam kompleks oktahedral, dua orbital berada pada tingkat energi tinggi (secara kolektif dikenal sebagai 'eg'), dan tiga orbital berada pada tingkat energi yang lebih rendah (secara kolektif dikenal sebagai t2g). Dalam kompleks tetrahedral, kebalikannya terjadi; tiga orbital berada pada tingkat energi yang lebih tinggi dan dua orbital pada tingkat energi yang lebih rendah.
Apa Itu Ligan Kuat?
Ligan kuat atau ligan medan kuat adalah ligan yang dapat menghasilkan pemisahan medan kristal yang lebih tinggi. Ini berarti, pengikatan ligan medan yang kuat menyebabkan perbedaan yang lebih tinggi antara orbital tingkat energi yang lebih tinggi dan lebih rendah. Contohnya termasuk CN- (ligan sianida), NO2- (ligan nitro) dan CO (ligan karbonil ligan).
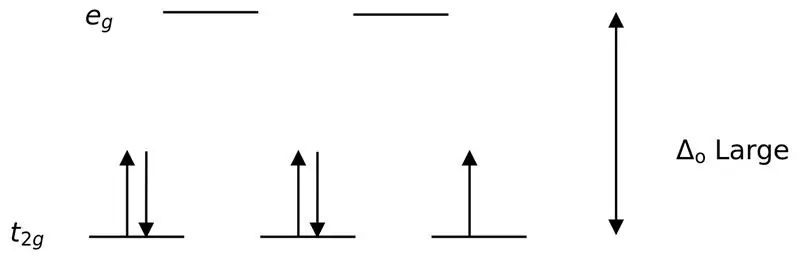
Gambar 02: Pemisahan Putaran Rendah
Dalam pembentukan kompleks dengan ligan-ligan ini, mula-mula orbital berenergi rendah (t2g) terisi penuh dengan elektron sebelum mengisi ke orbital tingkat energi tinggi lainnya (misalnya). Kompleks yang terbentuk dengan cara ini disebut “kompleks spin rendah”.
Apa itu Ligan Lemah?
Ligan lemah atau ligan medan lemah adalah ligan yang dapat menghasilkan pemisahan medan kristal yang lebih rendah. Ini berarti, pengikatan ligan medan lemah menyebabkan perbedaan yang lebih rendah antara orbital tingkat energi yang lebih tinggi dan lebih rendah.
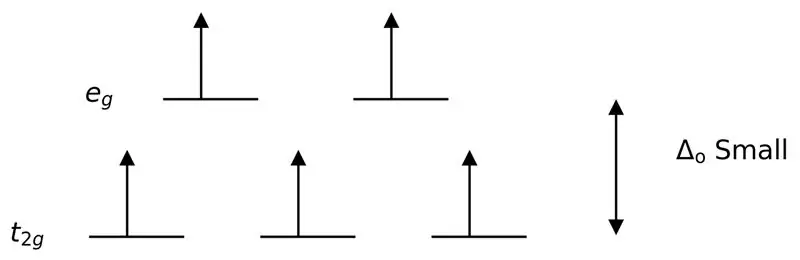
Gambar 3: Pemisahan Putaran Tinggi
Dalam hal ini, karena perbedaan rendah antara dua tingkat orbital menyebabkan tolakan antara elektron pada tingkat energi tersebut, orbital berenergi lebih tinggi dapat dengan mudah diisi dengan elektron jika dibandingkan dengan orbital berenergi rendah. Kompleks yang terbentuk dengan ligan ini disebut "kompleks spin tinggi". Contoh ligan medan lemah termasuk I- (ligan iodida), Br- (ligan bromida), dll.
Apa Perbedaan Ligan Kuat dan Ligan Lemah?
Lig Kuat vs Ligan Lemah |
|
| Ligan kuat atau ligan medan kuat adalah ligan yang dapat menghasilkan pemisahan medan kristal yang lebih tinggi. | Ligan lemah atau ligan medan lemah adalah ligan yang dapat menghasilkan pemisahan medan kristal yang lebih rendah. |
| Teori | |
| Pemisahan setelah mengikat ligan medan kuat menyebabkan perbedaan yang lebih tinggi antara orbital tingkat energi yang lebih tinggi dan lebih rendah. | Pemisahan orbital setelah mengikat ligan medan lemah menyebabkan perbedaan yang lebih rendah antara orbital tingkat energi yang lebih tinggi dan lebih rendah. |
| Kategori | |
| Kompleks yang terbentuk dengan ligan medan kuat disebut “kompleks spin rendah”. | Kompleks yang terbentuk dengan ligan medan lemah disebut “kompleks spin tinggi”. |
Ringkasan - Ligan Kuat vs Ligan Lemah
Ligan kuat dan ligan lemah adalah anion atau molekul yang menyebabkan pemecahan orbital d ion logam menjadi dua tingkat energi. Perbedaan antara ligan kuat dan ligan lemah adalah bahwa pemisahan setelah mengikat ligan medan kuat menyebabkan perbedaan yang lebih tinggi antara orbital tingkat energi yang lebih tinggi dan lebih rendah sedangkan pemisahan orbital setelah mengikat ligan medan lemah menyebabkan perbedaan yang lebih rendah antara yang lebih tinggi dan lebih rendah orbital tingkat energi.






