- Pengarang Alex Aldridge [email protected].
- Public 2023-12-17 13:42.
- Terakhir diubah 2025-06-01 07:36.
Perbedaan utama antara asam karbonat dan bikarbonat adalah bahwa asam karbonat adalah senyawa kimia netral, sedangkan bikarbonat adalah senyawa kimia bermuatan negatif.
Asam karbonat adalah asam lemah yang terbentuk dalam larutan ketika karbon dioksida dilarutkan dalam air, dengan rumus kimia H2CO3. Bikarbonat terbentuk dari kombinasi tiga atom oksigen, satu atom hidrogen, dan satu atom karbon dengan rumus kimia HCO3-.
Apa itu Asam Karbonat?
Asam karbonat adalah H2CO3. Terkadang, kami memberikan nama ini untuk larutan yang memiliki karbon dioksida terlarut dalam air atau air berkarbonasi. Hal ini karena air berkarbonasi mengandung sejumlah kecil H2CO3. Selanjutnya, asam karbonat adalah asam lemah, dan dapat membentuk dua jenis garam sebagai karbonat dan bikarbonat. Massa molar senyawa ini adalah 62,024 g/mol.
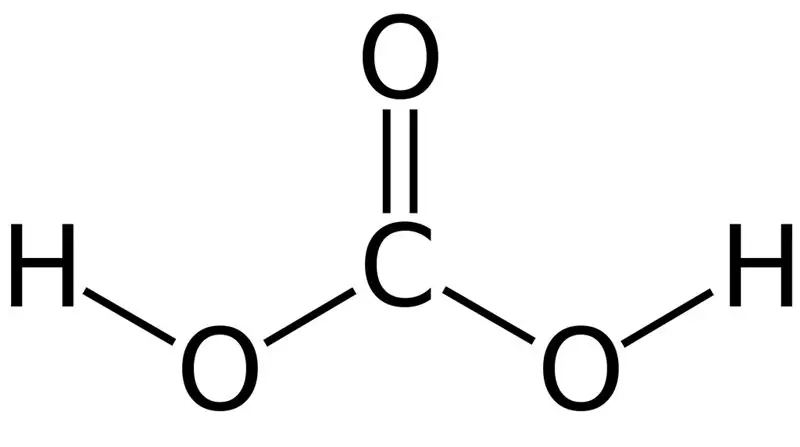
Gambar 01: Struktur Kimia Asam Karbonat
Saat karbon dioksida dilarutkan dalam air, ia memasuki keseimbangan antara karbon dioksida dan asam karbonat. Kesetimbangannya adalah sebagai berikut:
CO2 + H2O H2CO3
Jika kita menambahkan kelebihan asam karbonat ke basa, itu menghasilkan bikarbonat. Namun, jika basa berlebih, maka asam karbonat cenderung memberikan garam berkarbonasi. Lebih tepatnya, asam karbonat adalah senyawa asam karboksilat yang memiliki dua substituen gugus hidroksil yang terikat pada karbon karbonil. Selain itu, ini adalah asam poliprotik, yang mampu menyumbangkan proton. Ia memiliki dua proton yang dapat dilepas, jadi ia secara khusus diprotik.
Apa itu Bikarbonat?
Bikarbonat terbentuk dari kombinasi tiga atom oksigen, satu atom hidrogen, dan satu atom karbon. Produk dari kombinasi ini dapat berupa ion atau senyawa dengan lebih banyak elektron daripada proton. Kita dapat menggambarkannya sebagai spesies kimia yang memiliki rumus kimia HCO3-.
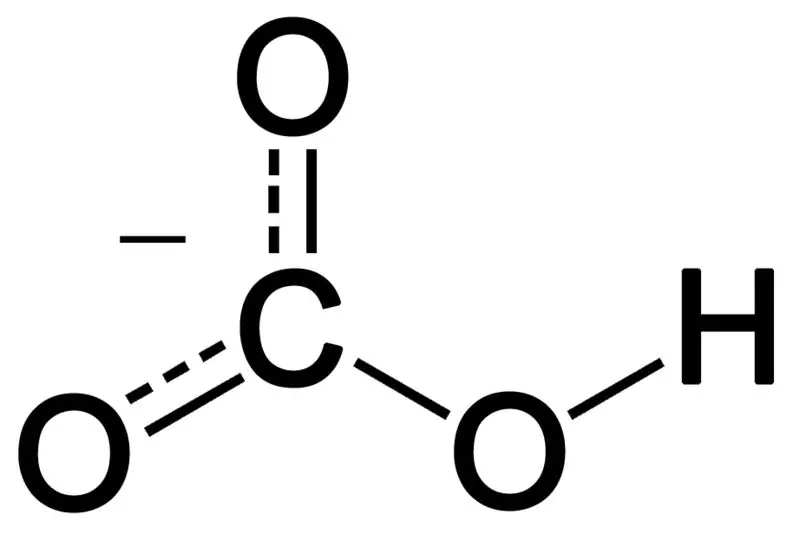
Gambar 02: Struktur Kimia Anion Bikarbonat
Senyawa ini adalah bagian penting dari sistem penyangga pH tubuh, dalam istilah awam: bertanggung jawab untuk menjaga darah seseorang dalam keadaan yang tidak terlalu asam atau terlalu basa. Selain itu, ini berfungsi sebagai cara menjaga cairan pencernaan tetap terkendali setelah perut selesai mencerna makanan. Selanjutnya, asam karbonat dalam air hujan membentuk ion bikarbonat ketika mengenai batuan. Aliran ion bikarbonat ini penting untuk menjaga siklus karbon tetap berjalan.
Apa Perbedaan Asam Karbonat dan Bikarbonat?
Asam karbonat adalah asam lemah yang terbentuk dalam larutan ketika karbon dioksida dilarutkan dalam air, dan rumus kimianya adalah H2CO3. Bikarbonat terbentuk dari kombinasi tiga atom oksigen, satu atom hidrogen, dan satu atom karbon dengan rumus kimia HCO3-. Perbedaan utama antara asam karbonat dan bikarbonat adalah bahwa asam karbonat adalah senyawa kimia netral, sedangkan bikarbonat adalah senyawa kimia bermuatan negatif. Selain itu, asam karbonat digunakan dalam pembuatan bergelembung, minuman bersoda, mengobati dermatitis, obat kumur, dll., sedangkan bikarbonat digunakan dalam persiapan makanan seperti memanggang (sebagai bahan pengembang), dan memberikan kemampuan untuk menahan perubahan pH.
Infografik berikut merangkum perbedaan antara asam karbonat dan bikarbonat dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan - Asam Karbonat vs Bikarbonat
Asam karbonat adalah H2CO3. Bikarbonat terbentuk dengan kombinasi tiga atom oksigen, atom hidrogen dan atom karbon, dengan rumus kimia HCO3-. Perbedaan utama antara asam karbonat dan bikarbonat adalah bahwa asam karbonat adalah senyawa kimia netral, sedangkan bikarbonat adalah senyawa kimia bermuatan negatif.






